Joner
advertisement

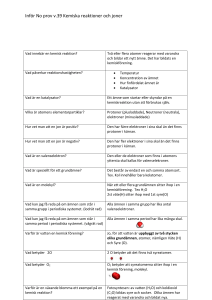
JONER -ÄR ALLTID LADDADE! OBS! DETTA ÄR EN GRUNDKURS! Grundkursens syfte är att använda enkla modeller och använda dem: • för att eleven ska få ett skelett att bygga vidare på - men modellernas begränsningar tas också upp • fortsätta att bygga vidare på nya modeller under kursens gång, för att få djupare förståelse för kemiska reaktioner • Lägga en bra grund för bl.a. elektrokemi, atomoch kärnfysik (vilka är de kurser inom kemi och fysik som kommer efter denna kurs) JONER • Joner kan man se som före detta atomer som blivit laddade genom att de fått eller blivit av med elektroner. • Jonens laddning beror på hur många elektroner den fått eller blivit av med. ÄDELGASSTRUKTUR – FULLA SKAL • Ädelgaserna har redan fulla skal – därför vill de inte reagera! • Atomer strävar efter att få fulla skal. • En del atomer vill väldigt gärna få fulla skal – då blir det en häftig reaktion. • Andra ämnen är inte alls lika reaktiva (eftersom det finns stabilare mellanlägen), som t.ex. koppar, silver och guld. I dessa fall blir det en långsam reaktion eller det kan t.o.m. vara svårt att få dem att reagera alls! ATOMER BLIR JONER: • Genom att avge en elektron får natrium fulla skal • Genom att ta upp en elektron får klor fulla skal • Det som hänt är att båda atomerna fått fulla skal, men nu är laddade, d.v.s. de är inte längre atomer utan JONER KOMMER ATOMEN SLÄNGA ELLER TA UPP ELEKTRONER? Dessa regler gäller när vi ritar joner och den stämmer för oss och vår förenklade atommodell: Om atomen har mindre än 4 elektroner i sitt yttersta skal (valenselektroner) så slänger den de elektronerna! Om atomen har fler än 4 elektroner i sitt yttersta skal (valenselektroner) så tar den upp elektroner så skalet blir fullt. Om atomen har 4 elektroner i sitt yttersta skal (t.ex. grundämnet kol) så delar den elektroner med andra atomer. (Se metanmolekylen på nästa bild!) METANMOLEKYLEN: KOL OCH 4 VÄTE SAMARBETAR FÖR ATT FÅ SÅ FULLA SKAL SOM MÖJLIGT!