Salter bildandet , reaktionssätt, sönderdelning och analys
advertisement

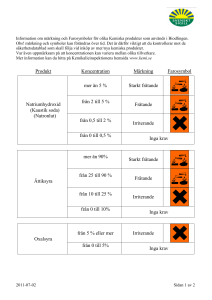
Salter bildandet , reaktionssätt, sönderdelning och analys Tillverka ett salt av en syra och en metall ..................................................................................... 2 Tillverka ett salt av en syra och en metall ..................................................................................... 2 Tillverka ett salt av en syra och en metalloxid ............................................................................... 3 Tillverka ett salt av en syra och metallkarbonat ............................................................................ 5 Sönderdelning av ammoniumkarbonat......................................................................................... 7 Sönderdelning av kopparkarbonat ............................................................................................... 9 Är metalloxider sura eller basiska och lösliga? ........................................................................... 11 Tillverkning och testning av saltsyra .......................................................................................... 14 Tillverkning och testning av salpetersyra.................................................................................... 16 Reagens för sulfatjoner och kloridjoner ...................................................................................... 18 1 Tillverka ett salt av en syra och en metall Teori: Det finns ädla och oädla metaller. De reagerar olika med syra. Du ska testa en oädel metall och se vad som händer. Material: 5,5 mol/dm3 saltsyra, zinkpulver, reaktionskärl med kork och smalt rör, 2 cm3 spruta, litet provrör, en liten bit silikonslang, tändstickor, Risker vid experimentet: Saltsyra är frätande och zinkpulver är miljöfarligt och mycket brännbart. Vätgas är extremt brännbart och zinkklorid är miljöfarligt och frätande. Använd skyddsglasögon och personlig skyddsutrustning. En riskbedömning ges av undervisande lärare. Gasuppsamlingsrör Zinkpulver Utförande: 1. Lägg en spatelspets zinkpulver i reaktionskärlet 2. Sätt på ett lock med en ”utgång” (det kan vara en sprutspets eller ett litet rör). 3. Fyll en spruta med 0,5 cm3 5,5 mol/dm3 saltsyra 4. Tillsätt ca 0,2 cm3 saltsyra och vänta ett tag. Vad händer? 5. Testa gasen i provröret. Lyft upp röret medan du håller för öppningen. För försiktigt en tändsticka mot mynningen och antänd gasen. Var försiktig och rikta inte öppningen mot någon person. 6. Tillsätt mera saltsyra och testa gasen igen. Svara på följande frågor: 1. Vad händer i reaktionskärlet när syran tillsätts? 2. Vad för slags produkt bildas (aggregationstillstånd)? 3. Vad finns i provröret INNAN reaktionen börjar? 4. Beskriv vad som händer när du antänder gasen! 5. Vilken gas har alltså bildats i reaktionskärlet? 6. Skriv en reaktionsformel för reaktionen i reaktionskärlet. 7. Skriv en formel för reaktionen med tändstickan. 8. Hur kan man samla upp gasen och veta att den finns kvar i provröret? 9. Om du skulle göra magnesiumsulfat, vilka reaktanter skulle du använda? Skriv en formel för denna reaktion. 2 Tillverka ett salt av en syra och en metalloxid Teori: En metalloxid ger en basisk vattenlösning och kallas för basisk oxid. Ett salt kan alltså bildas genom en neutralisation mellan en syra och en metalloxid. Material: Kopparoxid, CuO(s), svavelsyra, 2mol/dm3 H2SO4, etanolbrännare, reaktionskärl, glasstav som tål värme, tändstickor Riskbedömning: Svavelsyra är frätande. Peka aldrig en pipett som innehåller dessa ämnen uppåt så att ämnet kan komma/skvätta ut. Skölj huden med mycket vatten. Stänk i ögon sköljs omedelbart i ögondusch under lång tid. Glasstaven kan spricka och orsaka stänk vid avkylningen. Din lärare kommer att ge ytterligare riskbedömning. Spruta Värm glasstaven över mikrobrännaren och ….. 1 cm3 2M H2SO4 Lite CuO(s) … för ner den i Microlösningen brännare med kopparoxid Utförande: 1. Fyll mikrobrännaren med etanol. 2. Placera lite kopparoxid i reaktionskärlet. 3. Tillsätt 1 cm3 svavelsyra till reaktionskärlet med kopparoxiden. 4. Värm glasstaven över etanolbränn och för ner den varma staven i lösningen. Det kan skvätta och gå sönder när du för ner glasstaven i lösningen. Använd en glasstaven av pyrex eller en metallstav. 5. Upprepa uppvärmningen tills reaktion och färgförändring har skett. Låt ev. reaktionsblandningen stå över natt. Svara på följande frågor: 1. Vad har kopparoxid för färg? 2. Vilka joner ger lösningen dess färg? 3. Vad har hänt när du lämnat mikrotiterplattan/färgplattan över natt?(Dunstat in) 4. Vad är det för förening som har bildats? 5. Skriv formeln för reaktionen i ord och kemiska formler 6. Vad hade blivit skillnaden om du använt saltsyra istället för svavelsyra? 7. Om du ville tillverka magnesiumsulfat på liknande sätt. Vilka kemikalier hade du använt? 3 Till läraren: Riskbedömningsunderlag: Kopparoxid Hälsoskadligt miljöfarligt R 20/22, 50, S (2) 24/25 46R 20/22, 50, S (2) 24/25 46 Svavelsyra (konc) Frätande R 34, 37, 14 och S (1/2,) 26, 45, 30. Etanol mycket brandfarligt R 11 och S (2) 7, 16. Resultat: Den svarta kopparoxiden löses upp och blir blå (kopparsulfat) Ämne Mängd Kommentarer Kopparoxid 5g Tag endast liten mängs. Färgändringen är ändå tydlig 3 3 3 50 cm Svavelsyra 2M 0,55 cm konc till 50cm Öka konc eller mängd om reaktionen går långsamt Svar på frågor: 1. Vad har kopparoxid för färg? Svart 2. Vilka joner ger lösningen dess färg? Kopparjoner Cu2+ 3. Vad har hänt när du lämnat mikrotiterplattan/färgplattan över natt?(Dunstat in). Det har bildats kristaller. 4. Vad är det för förening som har bildats? Kopparsulfat och vatten 5. Skriv formeln för reaktionen i ord och kemiska formler. Kopparoxid och svavelsyra bildar kopparsulfat och vatten CuO + H2SO4 → CuSO4 + H2O 6. Vad hade blivit skillnaden om du använt saltsyra istället för svavelsyra? Det skulle bildas kopparklorid, CuCl2 7. Om du ville tillverka magnesiumsulfat på liknande sätt. Vilka kemikalier hade du använt? Magnesiumoxid och svavelsyra Centralt innehåll Åk 7-9 Kemiska föreningar och hur atomer sätts samman till molekyl-och jonföreningar genom kemiska reaktioner. Kemi 1 Syrabasreaktioner, inklusive pH-begreppet och buffertverkan. Tolkning och skrivning av formler för kemiska föreningar och reaktioner. Substansmängdsförhållanden, koncentrationer, begränsande reaktanter och utbyten vid kemiska reaktioner. Kvalitativa och kvantitativa metoder för kemisk analys, till exempel kromatografi och titrering 4 Tillverka ett salt av en syra och metallkarbonat Teori: Ett salt kan bildas genom en neutralisation mellan en syra och ett basiskt salt. Du ska tillverka ett salt genom att hälla saltsyra på kalciumkarbonat. Material: 5,5 M Saltsyra (HCl), kalciumkarbonat (CaCO3), kalkvatten (Ca(OH)2); etanol, reaktionskärl, spruta, pipetter, spruta, silikonslang med glasrör, etanolbrännare, glasstav. Riskbedömning: Saltsyra är frätande. Din lärare kommer att ge ytterligare riskbedömning. Utförande: 6. Gör i ordning ett reaktionskärl med en avledningsslang. Gör ett hål i korken och träd en glasrör igenom. Träd en silikonslang på glasröret. Silikonslangen ska vara så lång att den når ner till en liten bägare. Bägaren innehåller kalkvatten. 7. Placera två spatelspetsar kalciumkarbonat i reaktionskärlet och sätt på korken. 8. Tillsätt saltsyra i sprutan och gör i ordning bägaren med kalkvatten. Spruta med 0,5 cm3 5,5 M HCl Silikonslang CaCO3 Kalkvatten Ca(OH)2 Tillsätt försiktigt saltsyran så att den får reagera med kalciumkarbonatet När reaktionen avstannat i reaktionskärlet, lyft ur slangen från kalkvattnet. Tag av locket. Tänd en etanolbrännare och värm försiktigt en glasstav över lågan. För ner den varma glasstaven i reaktionskärlet. Upprepa tills volymen har sjunkit till hälften. 8. Låt reaktionskärlet stå över natt. Registrera vas som hänt. Rengör hela apparaten. 4. 5. 6. 7. Svara på följande frågor: 8. Vad händer i reaktionskärlet när saltsyra tillsätts? 9. Vad händer efter ett tag i bägaren med kalkvatten? 10. Vad säger detta (i fråga 2) om vilken gas som har bildats i reaktionskärlet? 11. Skriv reaktionsformler för vas som har bildats i bägaren med kalkvatten 12. Skriv en reaktionsformeln för reaktionen vas som sker i reaktionskärlet. 13. Vad har hänt i reaktionskärlet när det har stått över natt? 14. Skriv en balanserad reaktionsformel mellan kalciumkarbonat och saltsyra. 15. Vad skulle skillnaden vara om du hade använt salpetersyra istället för saltsyra? Skriv formler och namn. 5 Till läraren: Riskbedömningsunderlag: Saltsyra (HCl) konc. Frätande R 34, 37 och S (1/2), 26, 45 Saltsyra (HCl) 5,5 M Frätande R 36/37/38 och S(1/2), 26, 45, kalciumkarbonat (CaCO3) Irriterande R36 och S (2) 26 39 46 kalkvatten (Ca(OH)2) Frätande R34 och S (1/2) 22 25 26 36/37/39 45 Etanol Mycket brännbart R 11 och S (2) 7, 16. Resultat: Den svarta kopparoxiden löses upp och blir blå (kopparsulfat) Ämne Mängd Kommentarer Kaliumkarbonat 5g Öka konc eller mängd om reaktionen går långsamt 20 cm3 5,5 moldm3 HCl 9,0 cm3 12M HCl (konc) 11,0 cm3 H2O 100 cm3 kalkvatten Lös upp ca 4 g CaCl2 i ca 90 Nygjord fungerar bäst! cm3 vatten och droppa NaOH tills svag fällning syns Svar på frågor: 1. Vad händer i reaktionskärlet när saltsyra tillsätts? Koldioxid bildas då karbonatet sönderdelas Vad händer efter ett tag i bägaren med kalkvatten? Kalkvatten grumlas Vad säger detta (i fråga 2) om vilken gas som har bildats i reaktionskärlet? Karbonater är instabila i sur lösning: 2. Skriv reaktionsformler för vas som har bildats i bägaren med kalkvatten Ca(OH)2 + CO2(g) → CaCO3(s) + H2O 3. Skriv en reaktionsformeln för reaktionen vad som sker i reaktionskärlet. CaCO3 + 2HCl → CO2(g) + CaCl2(aq) + H2O 4. Vad har hänt i reaktionskärlet när det har stått över natt? Kalciumklorid har fallit ut. 5. Skriv en balanserad reaktionsformel mellan kalciumkarbonat och saltsyra. CaCO3 + 2HCl → CO2(g) + CaCl2(aq) + H2O 6. Vad skulle skillnaden vara om du hade använt salpetersyra istället för saltsyra? Skriv formler och namn. CaCO3 + 2HNO3 → CO2(g) + Ca(NO3) 2(aq) + H2O Centralt innehåll Åk 7-9 Kemiska föreningar och hur atomer sätts samman till molekyl-och jonföreningar genom kemiska reaktioner. Kemi 1 Syrabasreaktioner, inklusive pH-begreppet och buffertverkan. Tolkning och skrivning av formler för kemiska föreningar och reaktioner. Substansmängdsförhållanden, koncentrationer, begränsande reaktanter och utbyten vid kemiska reaktioner. Kvalitativa och kvantitativa metoder för kemisk analys, till exempel kromatografi och titrering 6 Sönderdelning av ammoniumkarbonat Teori: Ett instabilt ämne sönderdelas till andra ämnen genom värmning. De nya ämnena kan vara både fasta ämnen eller gaser. Här ska du sönderdela ammoniumkarbonat och se vad som bildas och identifiera en gas. Material: Ammoniumkarbonat; (NH4)2CO3 (s), universalindikator, avjoniserat vatten, reaktionskärl, mikrobrännare, ampull/igensmält glasrör, litet stativ och klämmare. Risker vid experimentet: Ammoniumkarbonat är hälsoskadigt. Andas inte in gasen. Etanol är brännbart. Plastdetaljer kan smälta och ta eld. Använd skyddsglasögon och personlig skyddsutrustning. En riskbedömning ges av undervisande lärare. Stativ Silikonslang Igensmält rör Ammoniumkarbonat (NH4)2CO3 Lock med öppning Mikrobrännare vatten med universalindikator Utförande: 1. Bägare och ampull: Smält ihop ett glasrör eller tag en ampull. Fyll denna med max ¼ ammoniumkarbonat. Montera ampullen/igensmälta glasröret horisontellt eller med liten frånlut med hjälp av stativet. Trä på en silikonslang. Fyll en bägare/burk med avjoniserat vatten och några droppar universalindikator. För ner silikonslang i bägaren. 2. Tänd mikrobrännaren och värm på försiktigt på ampullen genom att föra lågan under ammoniumkarbonatet. Bränn inte på silikonslangen! Fortsätt att värma till det inte kommer flera bubblor i vattnet. 3. Avbryt uppvärmningen genom att ta loss silikonslangen eller lyfta upp slangen från bägaren. Om man inte gör detta kan man lätt få baksug. Lukta försiktigt på vattenlösningen från bägaren. Diska utrusningen. Skriv ner dina resultat och svara på följande frågor. 1. Vilken färg har indikatorn från början och vilket pH finns i vattnet före experimentet? 2. Vilken färg har indikatorn efter uppvärmning? Vad är förklaringen? 3. Vad blir kvar i ampullen efter värmningen? 4. Vad luktar gasen? 5. Skriv reaktionen för sönderdelning av ammoniumkarbonat i ord och kemiska formler 7 Till Läraren: Riskbedömningsunderlag: Ammoniumkarbonat; Hälsoskadligt, miljöskadligt R 22 och S (1/2), 36/37, 46, ammoniak S (1/2) 26 36/37/39 45 61 etanol Mycket brandfarligt R 11 och S (2) 7, 16. ”Risker vid experimentet” gäller endast de kemikalier som nämnts, under förutsättning att beskrivna koncentrationer, mängder och metod används. Som lärare förväntas du göra en fullständig riskbedömning för dig själv och din elevgrupp. Resultat: Ammoniumkarbonat sönderdelas vid värmning till ammoniak, vatten och koldioxid. Det bildas ingen fast återstod. Kemikalie/lösning Annan information 30 g (NH4)2CO3 (s) Alt: NH4HCO3 Universalindikator BTB, metylorange Svar på frågor: 1. Vilken färg har indikatorn från början och vilket pH finns i vattnet före experimentet? Grön som tyder på neutralt pH-värde på vattnet. (Eller gult som tyder på svagt surt) 2. Vilken färg har indikatorn efter uppvärmning? Vad är förklaringen? Purpurfärg på grund av att ammoniakgas har gjort lösningen basisk 3. Vad blir kvar i ampullen efter värmningen? Ingenting är kvar ty allt har sönderdelats till gaser. 4. Vad luktar gasen? Ammoniak, stickande lukt. 5. Skriv reaktionen för sönderdelning av ammoniumkarbonat i ord och kemiska formler. (NH4)2CO3 (s) → 2NH3(g) + CO2(g) + H2O(l) Tips Man kan ta ammoniumvätekarbonat. Vattenlösningen blir svagt sur. Den luktar inte/endast lite ammoniak NH4HCO3 → NH3(g) + CO2(g) + H2O(l) Centralt innehåll Åk 7-9 Kemiska föreningar och hur atomer sätts samman till molekyl-och jonföreningar genom kemiska reaktioner. Systematiska undersökningar. Formulering av enkla frågeställningar, planering, utförande och utvärdering. Separations-och analysmetoder, till exempel destillation och identifikation av ämnen. Källkritisk granskning av information och argument som eleven möter i olika källor och samhällsdiskussioner med koppling till kemi. Kemi 1 Kemisk bindning och dess inverkan på till exempel förekomst, egenskaper och användningsområden för organiska och oorganiska ämnen Fällningsreaktioner. Kvalitativa och kvantitativa metoder för kemisk analys, till exempel kromatografi och titrering. Vad som kännetecknar en naturvetenskaplig frågeställning. Det experimentella arbetets betydelse för att testa, omvärdera och revidera hypoteser, teorier och modeller. Planering och genomförande av experiment samt formulering och prövning av hypoteser i samband med dessa. Utvärdering av resultat och slutsatser genom analys av metodval, arbetsprocess och felkällor. 8 Sönderdelning av kopparkarbonat Teori: Instabila ämnen kan sönderdelas till andra ämnen av syror eller genom värmning. De nya ämnena kan vara både fasta ämnen eller gaser. Här ska du sönderdela kopparkarbonat på två olika sätt. Du ska även identifiera en gas. Material: reaktionskärl, liten bägare, pipett, mikrobrännare, ampull/igensmält glasrör, litet stativ och klämmare. Koppar(II)karbonat, CuCO3(s), kalkvatten, Ca(OH)2(aq), 1 mol/dm3 svavelsyra; H2SO4(aq), Risker vid experimentet Svavelsyra är frätande. Etanol är brännbart. Plastdetaljer kan smälta och ta eld. Använd skyddsglasögon och personlig skyddsutrustning. En riskbedömning ges av undervisande lärare. Utförande: Stativ 1. Smält ihop ett glasrör Silikonslang Igensmält rör eller tag en ampull. Fyll Kopparkarbonat denna med max ¼ Lock med kopparkarbonat. öppning 2. Montera ampullen/igensmälta glasröret horisontellt Mikroeller med liten frånlut brännar Kalkvatten med hjälp av stativet. Trä e på en silikonslang. 3. Fyll en bägare/burk med kalkvattnet. För ner kalkvatten silikonslang i bägaren. Se bild. 4. Fyll reaktionskärlet med kalkvatten. Se till att det ena glasröret i locket går under ytan på kalkvattnet. Det andra glasröret ska inte gå under ytan. 5. Testa hur kopparkarbonat reagerar med en syra: Sätt en liten spatelspets kopparkarbonat i en bägare och tillsätt några droppar svavelsyra. Registrera vad som händer. 6. Tänd mikrobrännaren och värm på försiktigt på ampullen genom att föra lågan under kopparkarbonatet. Bränn inte på silikonslangen! 7. Fortsätt att värma tills det inte kommer flera bubblor i kalkvattnet. 8. Avbryt uppvärmningen genom att ta loss silikonslangen eller lyfta på locket. Om man inte gör detta kan man lätt få baksug. 9. När ampullen har svalnat tag lite av produkten och tillsätt en droppa svavelsyra. Vad händer? Diska utrusningen. Skriv ner dina resultat och svara på följande frågor. 6. Vilken färg har kopparkarbonat? Vilken färg har produkten efter uppvärmning? 7. Vad händer när kopparkarbonat utsätts för svavelsyra? 8. Vad händer när produkten utsätts för svavelsyra? Varför skiljer sig reaktionerna med svavelsyra mellan före och efter värmning åt? 9. Vad är kalkvatten reagens för? Skriv formler för reaktionen 10. Skriv formler för sönderdelning av kopparkarbonat i ord och kemiska formler. 9 Till Läraren: Riskbedömningsunderlag: Koppar(II)karbonat; CuCO3(s), Faktaunderlaget otillräckligt. Fara kan inte uteslutas - tillämpa försiktighetsprincipen kalkvatten; Ca(OH)2(aq) Frätande R 34 och S (1/2) 22 25 26 36/37/39 45 Svavelsyra konc Frätande R 34, 37, 14 och S (1/2,) 26, 45, 30. Etanol mycket brandfarligt R 11 och S (2), 7, 16. kopparoxid Faktaunderlag saknas Ej märkespliktig men det finns inte tillräckligt underlag. Använd försiktighetsprincipen ”Risker vid experimentet” gäller endast de kemikalier som nämnts, under förutsättning att beskrivna koncentrationer, mängder och metod används. Som lärare förväntas du göra en fullständig riskbedömning för dig själv och din elevgrupp. Resultat: Blekgrön kopparkarbonat sönderdelas till svart kopparoxid och koldioxid av både värme och syra. Spara produkten till laborationen ”Reduktion av kopparoxid” eller ”Reaktion mellan svavelsyra och kopparoxid Kemikalie/lösning Spädning Annan information Ca 30 g CuCO3 50 cm3 H2SO4 späd 3 ml konc. syra till 50 cm3 3 100 cm kalkvatten Lös upp ca 4 g CaCl2 i ca 90 Nygjord fungerar bäst! cm3 vatten och droppa NaOH tills svag fällning syns Svar på frågor: 1. Vilken färg har kopparkarbonat? Vilken färg har produkten efter uppvärmning? Svagt grön. Sen svart. 2. Vad händer när kopparkarbonat utsätts för svavelsyra? Det bubblar bort koldioxid. Karbonater är instabila med syra. CuCO3(s)+ H2SO4 →CuSO4(aq) + H2O + CO2(g) 3. Vad händer när produkten utsätts för svavelsyra? Varför skiljer sig reaktionerna med svavelsyra mellan före och efter värmning åt? Det händer ingenting. Kopparoxid är stabil mot syra. (Ev kan kopparoxid neutraliseras och bilda kopparsulfat(blå) CuO + H2SO4 → Cu SO4 + H2O) 4. Vad är kalkvatten reagens för? Skriv formler för reaktionen Reagens för koldioxid. Bildar en fällning av kalciumkarbonat Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O(l) 5. Skriv formler för sönderdelning av kopparkarbonat i ord och kemiska formler CuCO3(s) →(värme) CuO(s) + CO2(g)” Centralt innehåll Åk 7-9Kemiska föreningar och hur atomer sätts samman till molekyl-och jonföreningar genom kemiska reaktioner. Systematiska undersökningar. Formulering av enkla frågeställningar, planering, utförande och utvärdering. Separations-och analysmetoder, till exempel destillation och identifikation av ämnen. Källkritisk granskning av information och argument som eleven möter i olika källor och samhällsdiskussioner med koppling till kemi. Kemi 1Kemisk bindning och dess inverkan på till exempel förekomst, egenskaper och användningsområden för organiska och oorganiska ämnen Fällningsreaktioner. Kvalitativa och kvantitativa metoder för kemisk analys, till exempel kromatografi och titrering. Vad som kännetecknar en naturvetenskaplig frågeställning. Det experimentella arbetets betydelse för att testa, omvärdera och revidera hypoteser, teorier och modeller. Planering och genomförande av experiment samt formulering och prövning av hypoteser i samband med dessa. Utvärdering av resultat och slutsatser genom analys av metodval, arbetsprocess och felkällor. 10 Är metalloxider sura eller basiska och lösliga? Teori: När grundämnen reagerar med luftens syre bildas oxider. Är det metaller bildas metalloxider. Du ska testa om vattenlösningar av dessa oxider är sura eller basiska. Material: Natriumoxid:Na2O, kalciumoxid: CaO, magnesiumoxid; MgO, Universalindikator, 24 brunnars mikrotiterplatta, 3 pipetter, en liten spatel, tandpetare. Riskbedömning: Alla oxider är farliga att förtära. Natriumoxid är mycket frätande. Använd glasögon. Din lärare kommer att ge ytterligare riskbedömning. Kalciumoxid Magnesiumoxi d Natriumoxid Vatten och en droppe universalindikator Utförande: 1. Fyll fyra brunnar med vatten. Droppa en droppe universalindikator i varje brunn 2. Tag med en liten spatelspets lika mycket av oxiderna, natriumoxid, kalciumoxid och magnesiumoxid en i varje brunn. 3. Rör runt med tandpetare. Registrera färg på indikatorn i tabell Resultat: Skriv ner dina iakttagelser och svara på följande frågor: Substans tillsatt Färg på indikator pH A1 A2 A3 A4 Endast vatten Syra/bas Svara på följande frågor: 1. Är metaller i vatten basiska eller sura? 2. Skriv reaktionsformler för reaktionerna mellan metalloxid och vatten. 11 Till läraren: Riskbedömningsunderlag: : Natriumoxid:Na2O Frätande R34 och S (1/2), 26, 28, 36/37/39, 45 Kalciumoxid: CaO Frätande R 34 och S (1/2), 26, (39), 36/37, 45, Magnesiumoxid; MgO Ej märkespliktig Universalindikator Ej märkespliktig Resultat: Skriv ner dina iakttagelser och svara på följande frågor: Substans tillsatt Färg på indikator pH Syra/bas A1 Na2O Mörk violett Ca 9,5-14 bas A2 CaO violett Ca 8,5-9,5 bas A3 MgO Grönaktig violett Ca 7,5-8,5 bas A4 Vatten grön Ca 7 neutral Svara på följande frågor: 1. Är metaller i vatten basiska eller sura? metalloxider ger basiska vattenlösningar. 2. Skriv reaktionsformler för reaktionerna mellan metalloxid och vatten. Na2O + H2O → 2NaOH natriumhydroxid (mycket lättlösligt) CaO + H2O → Ca(OH)2 kalciumhydroxid (lite svårlösligt) MgO + H2O → Mg(OH)2 magnesiumhydroxid (svårlösligt) Centralt innehåll Åk 7-9 Kemiska föreningar och hur atomer sätts samman till molekyl-och jonföreningar genom kemiska reaktioner. Kemi 1 Syrabasreaktioner, inklusive pH-begreppet och buffertverkan. Tolkning och skrivning av formler för kemiska föreningar och reaktioner. Substansmängdsförhållanden, koncentrationer, begränsande reaktanter och utbyten vid kemiska reaktioner. Kvalitativa och kvantitativa metoder för kemisk analys, till exempel kromatografi och titrering 12 Till Läraren: Svara på följande frågor: 1. Vad händer i reaktionskärlet när syran tillsätts? Det börjar bubbla. 2. Vad för slags produkt bildas (aggregationstillstånd)? Det bildas en gas. 3. Vad finns i provröret INNAN reaktionen börjar? Det finns luft (syre) 4. Beskriv vad som händer när du antänder gasen! Det blir en knall 5. Vilken gas har alltså bildats i reaktionskärlet? Vätgas 6. Skriv en reaktionsformel för reaktionen i reaktionskärlet. Zn(s) + 2HCl(aq) → H2(g) + ZnCl2(aq) 7. Skriv en formel för reaktionen med tändstickan. 2H2 + O2 → 2H2O (knallgasreaktionen) 8. Hur kan man samla upp gasen och veta att den finns kvar i provröret? Vätgas är lättare än luft (lägre densitet) 9. Om du skulle göra magnesiumsulfat, vilka reaktanter skulle du använda? Skriv en formel för denna reaktion. Mg(s) + H2SO4 (aq) → H2(g) + MgSO4(aq) Riskbedömningsunderlag: Saltsyra Frätande R 34, 37 och S (1/2), 26, 45 Zinkpulver Miljöfarligt och mycket brandfarligt R 50, 53 och S (2), 43, 46, 60, 61 Vätgas Extremt brandfarligt R 12 och S (2), 9, 16, 33 Zinkklorid Miljöfarligt och frätande R 34, 22, 50, 53 och S (1/2), 26, 36/37/39, 45, 60, 61. ”Risker vid experimentet” gäller endast de kemikalier som nämnts, under förutsättning att beskrivna koncentrationer, mängder och metod används. Som lärare förväntas du göra en fullständig riskbedömning för dig själv och din elevgrupp. Centralt innehåll Åk 7-9 Kemiska föreningar och hur atomer sätts samman till molekyl-och jonföreningar genom kemiska reaktioner. Kemi 1 Syrabasreaktioner, inklusive pH-begreppet och buffertverkan. Tolkning och skrivning av formler för kemiska föreningar och reaktioner. Substansmängdsförhållanden, koncentrationer, begränsande reaktanter och utbyten vid kemiska reaktioner. Kvalitativa och kvantitativa metoder för kemisk analys, till exempel kromatografi och titrering 13 Tillverkning och testning av saltsyra Teori: Du ska tillverka och titta på egenskaper hos saltsyra. Materiel: konc. svavelsyra (H2SO4), natriumklorid (NaCl), 0,1 M silvernitrat (AgNO3), universalindikator, två reaktionskärl/bägare med anslutningar, en spruta, två små provrör. Risker vid experimentet: Svavelsyra är frätande, silvernitrat är miljöfarligt och ger fläckar på händer och kläder. Använd skyddsglasögon och personlig skyddsutrustning. En riskbedömning ges av undervisande lärare. Utförande: 1. Innan försöket kan börja värms flaskan som innehåller svavelsyra i varmt vatten. Spruta 2. Tillsätt en spatel natriumklorid i ett reaktionskärl och vatten i det andra bägaren/kärlet. 3. Sätt ihop reaktionskärlen enl. figur. 4. Fyll sprutan med 0,5 cm3 ljummen svavelsyra. 5. Tillsätt svavelsyran droppvis och långsamt. Registrera vad som händer. 6. När inga fler bubblor syns i bägaren med vatten kan du öppna korken. För över lite av vattenlösningen till två provrör. Testa produkten! 0,5 cm3 13,5 M H2SO4 Silikonslang Öppning för övertryck NaCl(s) Bägare med vatten 7. Tillsätt några droppar universalindikator i det ena av provrören och några droppar silvernitrat i det andra provröret. Vad händer? Svara på frågorna: 1. Vad händer i reaktionskärlet med natriumklorid när du sätter till svavelsyra? 2. Vad händer samtidigt i bägaren/kärlet med vatten? 3. Vad är namnet på gasen som bidas? 4. Vilken färg har universalindikatorn med endast vattnet. Vilket pH har vatten? 5. Vilken färg fick universalindikatorn när du tillsatt vatten efter reaktionen? Är lösningen sur eller basisk? 6. Vad hände i provröret med silvernitrat efter tillsats? Kan du skriva en formel? 7. Kan du skriva en balanserad formel för reaktionen mellan svavelsyra och natriumklorid? 14 Till läraren: Riskbedömningsunderlag: Svavelsyra konc. Frätande R 34, 37, 14 och S (1/2,) 26, 45, 30 Natriumklorid ej märkespliktigt Saltsyra 0,1 M Irriterande S (1/2) 26 45, Silvernitrat(s) Frätande Miljöfarligt R 34, 50, 53 och S (1/2) 26 45 60 61 Silvernitrat 0,1 M Irriterande Miljöfarligt R 52, 53 och S (1/2) 26 45 60 61 Silverklorid Miljöfarligt R 50 och S 24/25 Universalindikator ej märkespliktigt ”Risker vid experimentet” gäller endast de kemikalier som nämnts, under förutsättning att beskrivna koncentrationer, mängder och metod används. Som lärare förväntas du göra en fullständig riskbedömning för dig själv och din elevgrupp. Resultat: Det bildas väteklorid som löser sig i vattnet till saltsyra. Kloridjonen visas med fällning med silverjoner. Svar på frågorna: 1. Vad händer i reaktionskärlet med natriumklorid när du sätter till svavelsyra? Det bildas en gas 2. Vad händer samtidigt i bägaren/kärlet med vatten? Det bubblar 3. Vad är namnet på gasen som bidas? Väteklorid; HCl(g) 4. Vilken färg har universalindikatorn med endast vattnet. Vilket pH har vatten? Indikatorn visar neural färg. 5. Vilken färg fick universalindikatorn när du tillsatt vatten efter reaktionen? Är lösningen sur eller basisk? Indikatorn ändrar färg. Indikerar på sur lösning 6. Vad hände i provröret med silvernitrat efter tillsats? Kan du skriva en formel? Det bildas en fällning Ag+ + Cl- → AgCl(s) 7. Kan du skriva en balanserad formel för reaktionen mellan svavelsyra och natriumklorid? H2SO4(aq) + NaCl(s) → 2HCl (g) + Na2SO4(aq) Centralt innehåll Åk 7-9 Kemiska föreningar och hur atomer sätts samman till molekyl-och jonföreningar genom kemiska reaktioner. Systematiska undersökningar. Formulering av enkla frågeställningar, planering, utförande och utvärdering. Separations-och analysmetoder, till exempel destillation och identifikation av ämnen. Källkritisk granskning av information och argument som eleven möter i olika källor och samhällsdiskussioner med koppling till kemi. Kemi 1 Kemisk bindning och dess inverkan på till exempel förekomst, egenskaper och användningsområden för organiska och oorganiska ämnen Fällningsreaktioner. Kvalitativa och kvantitativa metoder för kemisk analys, till exempel kromatografi och titrering. Vad som kännetecknar en naturvetenskaplig frågeställning. Det experimentella arbetets betydelse för att testa, omvärdera och revidera hypoteser, teorier och modeller. Planering och genomförande av experiment samt formulering och prövning av hypoteser i samband med dessa. Utvärdering av resultat och slutsatser genom analys av metodval, arbetsprocess och felkällor. 15 Tillverkning och testning av salpetersyra Teori: Du ska tillverka och titta på egenskaper hos salpetersyra. Materiel: 9 M svavelsyra ( H2SO4 ), kaliumnitrat (KNO3), koppartråd (Cu), två reaktionskärl med anslutningar, en spruta, Risker vid experimentet: Svavelsyra och salpetersyra är frätande, kväveoxider är giftiga. Använd skyddsglasögon och personlig skyddsutrustning. En fullständig riskbedömning ges av undervisande lärare. Utförande: 1. Fyll ett reaktionskärl med en spatelspets kaliumnitrat. Spruta 2. Fyll en spruta med 1 cm3 9M svavelsyra 1 cm3 3. Droppa försiktigt ned svavelsyran på 9M på det fasta nitratet H2SO4 4. Tvätta sprutan från rester av svavelsyran med vatten och torka sprutan ordentligt med papper. Testa produkten! KNO3 5. Stoppa mer lite koppartråd i det andra reaktionskärlet. Lösningen från första reaktionskärlet Öppning för övertryck Stäng efter tillsats av lösning ovan! Koppartråd 6. Sug upp lösningen från första reaktionskärlet i den torra sprutan. 7. Droppa lösningen över kopparen enl. fig. När allt har droppats över sätt på en kork på övertycksskyddet. 8. Studera vad som händer med koppartråden. Svara på följande frågor: 1. Vilken syra bildas när du droppar svavelsyra på kaliumnitrat? Det nya saltet som bildas heter kaliumvätesulfat. KHSO4. 2. Skriv en balanserad reaktionsformel för reaktionen 3. Vad händer i det andra reaktionskärlet när du droppar över lösningen på koppartråden? 4. Ser du några bubblor och någon färg i andra reaktionskärlet? 5. Varför skulle du sluta till det andra reaktionskärlet? 6. Titta på reaktionsformeln. Stämmer den med dina iakttagelser? 8 HNO3 + 3Cu → 3 Cu(NO3)2 + 4H2O + 2NO (färglös gas) 2NO + O2 → 2NO2 (brun) 16 Till läraren: Riskbedömningsunderlag: Svavelsyra 16 M Frätande R 34, 37, 14 och S (1/2,) 26, 45, 30. Svavelsyra 1M Frätande R 36/38 och S (1/2), 26, 45, 30 Salpetersyra 4M Frätande R 34,35 och S (1/2), 23, 26, 36, 45 Kaliumnitrat Miljöfarligt R50, oxiderande med brännbart R8 och S17 Kvävemonoxid Mycket giftigt R 26,37 oxiderande brännbart R7 S (1/2) 28 36/37 38 45 (63) Kvävedioxid Mycket giftigt R 26,34 och S (1/2) 9 26 28 36/37/39 45 Kaliumvätesulfat. Frätande 34,37och S (1/2) 26 36/37/39 45 ”Risker vid experimentet” gäller endast de kemikalier som nämnts, under förutsättning att beskrivna koncentrationer, mängder och metod används. Som lärare förväntas du göra en fullständig riskbedömning för dig själv och din elevgrupp. Svar på frågorna: 1. Vilken syra bildas när du droppar svavelsyra på kaliumnitrat? Det nya saltet som bildas heter kaliumvätesulfat. KHSO4. Syran heter salpetersyra 2. Skriv en balanserad reaktionsformel för reaktionen H2SO4 + KNO3 → HNO3 + KHSO4 3. Vad händer i det andra reaktionskärlet när du droppar över lösningen? Det kommer bubblor som ser ut att komma från koppartråden 4. Ser du några bubblor och någon färg i andra reaktionskärlet? Det bildas en gas som är brun 5. Varför skulle du sluta till det andra reaktionskärlet? Kväveoxider är giftiga. Kvävemonoxid är färglöst med den reagerar snabbt i syra till kvävedioxid (brun gas). Lösningen blir grönfärgad av kopparnitrat 6. Titta på reaktionsformeln. Stämmer den med dina iakttagelser? 8 HNO3 + 3Cu → 3 Cu(NO3)2 + 4H2O + 2NO (färglös gas) 2NO + O2 → 2NO2(brun) Centralt innehåll Åk 7-9 Kemiska föreningar och hur atomer sätts samman till molekyl-och jonföreningar genom kemiska reaktioner. Systematiska undersökningar. Formulering av enkla frågeställningar, planering, utförande och utvärdering. Separations-och analysmetoder, till exempel destillation och identifikation av ämnen. Källkritisk granskning av information och argument som eleven möter i olika källor och samhällsdiskussioner med koppling till kemi. Kemi 1 Kemisk bindning och dess inverkan på till exempel förekomst, egenskaper och användningsområden för organiska och oorganiska ämnen Fällningsreaktioner. Kvalitativa och kvantitativa metoder för kemisk analys, till exempel kromatografi och titrering. Vad som kännetecknar en naturvetenskaplig frågeställning. Det experimentella arbetets betydelse för att testa, omvärdera och revidera hypoteser, teorier och modeller. Planering och genomförande av experiment samt formulering och prövning av hypoteser i samband med dessa. Utvärdering av resultat och slutsatser genom analys av metodval, arbetsprocess och felkällor. 17 Reagens för sulfatjoner och kloridjoner Teori: Du ska ”leta joner” genom att experimentera med några klassiska tester och testa deras giltighet. Material: mikrotiterplatta, 6 st plastpipett, vatten. Del 1: 1 mol/dm3 svavelsyra (H2SO4), 11 mol/dm3 saltsyra (HCl konc), 0,5 mol/dm3 natriumkarbonat (Na2CO3), 0,5 mol/dm3 zinknitrat (Zn(NO3)2), 0,5 mol/dm3 bariumklorid (BaCl2). Del 2: 0,1 mol/dm3 natriumklorid (NaCl), 0,1 mol/dm3 natriumbromid (NaBr), 0,1 mol/dm3natriumjodid (NaI), 0,1 mol/dm3,silvernitrat (AgNO3), 2 mol/dm3 salpetersyra (HNO3) . Risker vid experimentet: Syror är frätande, bariumklorid är giftigt, zinknitrat är oxiderande, silvernitrat frätande och miljöfarligt. Använd skyddsglasögon och personlig skyddsutrustning. En riskbedömning ges av undervisande lärare. Utförande: Del 1 1. Markera 4 brunnar A1, A2, A3 och A4. Tillsätt 5 droppar vatten i brunn A1. 2. Tillsätt 5 droppar av följande: svavelsyra i A2, natriumkarbonat i A3 och zinknitrat i A4. 3. Med en ren pipett tillsätt 3 droppar bariumklorid i varje brunn A1 till A4. Observera och notera vad som händer. 4. Med en ren pipett tillsätt 3 droppar 11 M saltsyra i varje brunn A1 till A4. Registrera vad som händer. 5. Tvätta rent mikrotiterplattan till del 2. Del 2 6. Tillsätt 5 droppar vatten i brunn A1. 7. Tillsätt 5 droppar av följande: natriumklorid i brunn A2, natriumbromid i A3 och natriumjodid i A4. 8. Tillsätt 2 droppar salpetersyra och 3 droppar silvernitrat i varje brunn A1 till A4 9. Observera och notera vad som händer omedelbart. Låt stå en 5 minuter och läs av resultaten igen. Tvätta rent mikrotiterplattan. Svara på följande frågor: 1. Vad händer i A1 till A4 när du tillsätter bariumklorid? I vilka brunnar får du en fällning? 2. Skriv reaktionsformler där det sker en utfällning. 3. Kan tillsatts av bariumklorid vara ett test för närvaro av sulfatjoner? Motivera ditt svar! 4. Vad ser du när du tillsätter saltsyran? Ge en förklaring! 5. Skriv en formel som visar på vad som händer. 6. Dra slutsats om hur man bör testa sulfatjoner i en lösning. Del 2 7. Fyll i följande tabell med dina resultat Brunn Halidlösning Första utseendet Slutgiltigt utseende A1 A2 A3 A4 8. Hände en reaktion i någon av brunnarna A1 till A3? 9. Skriv en balanserad formel för dessa reaktioner 10. Är det möjligt att skilja vilken halid som är närvarande efter tillsats av silvernitrat 18 Till Läraren: Resultat Del 1 (del 2 se nedan) Brunn ämne Tillsats av bariumklorid A1 Vatten Inget händer A2 Svavelsyra Mjölkvit fällning A3 Na-karbonat Mjölkvit fällning A4 zinknitrat Inget händer Tillsats av saltsyra Inget händer Inget ytterligare händer Fällningen löses upp Inget händer Svar på frågorna: 1. Vad händer i A1 till A4 när du tillsätter bariumklorid? I vilka brunnar får du en fällning? En fällning bildas i A2 och A3. 2. Skriv reaktionsformler där det sker en utfällning. H2SO4(aq) + BaCl2 (aq) → BaSO4(s) + 2HCl(aq) Na2CO3(aq) + BaCl2 (aq) → BaCO3(s) + 2NaCl(aq) 3. Kan tillsatts av bariumklorid vara ett test för närvaro av sulfatjoner? Motivera ditt svar! Nej, även karbonat bildar en fällning med barium. 4. Vad ser du när du tillsätter saltsyran? Ge en förklaring! Fällningen går i lösning. Man kanske kan se några bubblor av koldioxid 5. Skriv en formel som visar på vad som händer. BaCO3(s) + 2HCl(aq) → CO2(g) + 2H2O + BaCl2 (aq) 6. Dra slutsats om hur man bör testa sulfatjoner i en lösning. Om det blir en fällning med bariumklorid så kan det vara sulfat- eller karbonatjoner i lösningen. Man bör även testa med saltsyra för att se om fällning är stabil. Först då kan man dra slutsats att det är sulfatjoner i lösningen eller ej. Del 2 7. Fyll i följande tabell med dina resultat Brunn Halidlösning Första utseendet Slutgiltigt utseende A1 Endast vatten ofärgat ofärgat A2 Natriumklorid Vit fällning Vit fällning A3 Natriumbromid Vit fällning Gulvit fällning A4 Natriumjodid Vit fällning Gul fällning 8. Hände en reaktion i någon av brunnarna A2 till A4? Nej samma vita fällning bildas. 9. Skriv en balanserad formel för dessa reaktioner. A2: NaCl(aq) + AgNO3(aq) → AgCl(s) + NaNO3(aq) A3: NaBr(aq) + AgNO3(aq) → AgBr(s) + NaNO3(aq) A4: NaI(aq) + AgNO3(aq) → AgI(s) + NaNO3(aq) 10. Är det möjligt att skilja vilken halid som är närvarande efter tillsats av silvernitrat. Ja, för efter ett tag får fällningarna olika utseenden. Riskbedömningsunderlag: svavelsyra (H2SO4) Frätande R 34, 37, 14 och S (1/2,) 26, 45, 30. saltsyra (HCl konc) Frätande R 34, 37 och S (1/2), 26, 45 natriumkarbonat (Na2CO3) Irriterande R 36 och S (2), 22, 26 zinknitrat (Zn(NO3)2 Oxiderande och hälsoskadligt R 8, 22 och S (2) 20 46 bariumsulfat (BaSO4) Ämnet är undantaget Kemikalieinspektionens föreskrift bariumkarbonat (BaCO3) Hälsoskadligt R20/22 och S (2) 28 bariumklorid (BaCl2)(s) Giftigt R20, 25 och S (1/2),45 bariumklorid 0,1 M Giftigt och hälsoskadligt R22 och S (1/2), 45 natriumklorid (NaCl) ej märkespliktigt natriumbromid (NaBr) Hälsoskadligt R22 och S 2 46 19 natriumjodid (NaI) Hälsoskadligt och miljöfarligt R 22, 50 och S 2 46 silvernitrat (AgNO3(s)) Frätande och miljöfarligt R 34, 50, 53 och S (1/2) 26 45 60 61 silvernitrat 0,1 M Irriterande och miljöfarligt R 52, 53 och S (1/2) 26 45 60 61 silverklorid (AgCl) Miljöfarligt R 50 och S 24/25 silverbromid(AgBr) Underlag otillräckligt salpetersyra (HNO3)konc. Frätande och oxiderande R 35, 8 och S (1/2), 23, 26, 36, 45 salpetersyra 2 M Frätande R 34,35 och S (1/2), 23, 26, 36, 45 ”Risker vid experimentet” gäller endast de kemikalier som nämnts, under förutsättning att beskrivna koncentrationer, mängder och metod används. Som lärare förväntas du göra en fullständig riskbedömning för dig själv och din elevgrupp Centralt innehåll Åk 7-9 Kemiska föreningar och hur atomer sätts samman till molekyl-och jonföreningar genom kemiska reaktioner. Systematiska undersökningar. Formulering av enkla frågeställningar, planering, utförande och utvärdering. Separations-och analysmetoder, till exempel destillation och identifikation av ämnen. Källkritisk granskning av information och argument som eleven möter i olika källor och samhällsdiskussioner med koppling till kemi. Kemi 1 Kemisk bindning och dess inverkan på till exempel förekomst, egenskaper och användningsområden för organiska och oorganiska ämnen Fällningsreaktioner. Kvalitativa och kvantitativa metoder för kemisk analys, till exempel kromatografi och titrering. Vad som kännetecknar en naturvetenskaplig frågeställning. Det experimentella arbetets betydelse för att testa, omvärdera och revidera hypoteser, teorier och modeller. Planering och genomförande av experiment samt formulering och prövning av hypoteser i samband med dessa. Utvärdering av resultat och slutsatser genom analys av metodval, arbetsprocess och felkällor. 20 21